Адипозогенитальная патология (Адипозогенитальная дистрофия, Синдром Фрелиха) — это редкое заболевание нейроэндокринной системы, которое характеризуется прогрессированием ожирения и нарушением функции половых желез.
Это заболевание также известно как болезнь Фрелиха или синдром Пэкрантца-Бабинского-Фрелиха, именуемое в честь ученых, обнаруживших и описавших его.
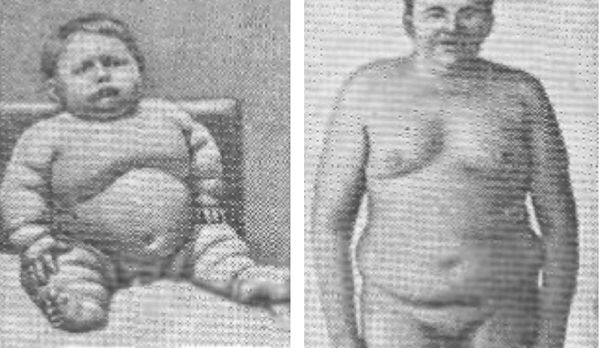
Адипозогенитальная патология [18]
Адипозогенитальная дистрофия является частью синдрома, который сочетает в себе эндокринные, метаболические и поведенческие нарушения, вызванные поражением гипофиза и гипоталамуса.
Частота появления
Это заболевание встречается в три раза чаще у мальчиков и обычно проявляется в возрасте 6-13 лет. Может являться как одним из проявлений другого заболевания, так и развиваться самостоятельно.
Причины адипозогенитальной патологии
Развитие этого заболевания может быть обусловлено:
- наличием краниофарингиомы (редкой опухоли головного мозга) и её последующим удалением;
- наличием аденомы гипофиза;
- гидроцефалией третьего желудочка головного мозга, нейроинфекциями, такими как энцефалит, менингит (включая туберкулез или сифилис), перенесенными в детстве.
Наследственным путем адипозогенитальная патология не передается.
При появлении аналогичных признаков следует обратиться к врачу. Не экспериментируйте сами с собой — это опасно для вашего организма!
Признаки адипозогенитальной дистрофии
Адипозогенитальная дистрофия чаще всего проявляется в детском и подростковом возрасте, но при невыявленной своевременно и нелеченной данное заболевание может возникнуть и у взрослых.
Признаки появляются постепенно: человек постепенно набирает вес, со временем развивается ожирение. Это происходит из-за приступов булимии, или «волчьего аппетита», — во время еды пациент не может остановиться и за короткое время съедает слишком много. Приступы не связаны с эмоциональным напряжением, а вызваны отсутствием ощущения сытости — человек не понимает, когда нужно прекратить есть.
Жировые отложения при адипозогенитальной дистрофии основным образом скапливаются в области бедер, живота, груди и лица. У девочек-подростков и женщин отсутствуют молочные железы, на их месте находятся жировые осадки, нет менструации, так как матка и яичники не развиваются должным образом. У мальчиков в период полового созревания яички не увеличиваются, сохраняется высокий тембр голоса, наблюдается эвнухоидное телосложение, возможно присутствие гинекомастии . Во взрослом возрасте снижается сексуальное влечение и развивается бесплодие .
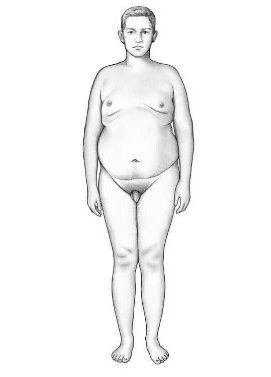
Эвнухоидное телосложение
Из-за дефицита половых гормонов закрываются позднее точки окостенения, и «костный возраст» отстает от паспортного (т. е. кости не могут «созреть», окрепнуть). При этом рост чаще всего в норме, мышцы также развиты правильно. Однако если опухоль головного мозга повлияла на выработку гормона роста — соматотропина, то рост будет низким.
Кроме того, при образованиях гипофиза или гипоталамуса может ухудшаться зрение, повышаться внутричерепное давление и болеть голова, возникать патологическая сонливость — желание спать не только ночью, но и днем. Появляется усталость и снижается работоспособность, иногда может возникать сухость во рту и жажда . Также может развиваться сложный набор эмоциональных, когнитивных и поведенческих расстройств: гнев, апатия, депрессия, признаки, напоминающие синдром Корсакова, аутистическое расстройство и психотические состояния . Однако на умственные способности синдром не влияет, интеллектуальное развитие соответствует возрасту.
Патогенез адипозогенитальной дистрофии
Заболевание Френлиха формируется из-за поражения гипоталамуса. На процесс полового созревания, функционирование половых желез и способность к плодоношению оказывает воздействие небольшое количество клеток, которые распределены между двумя областями гипоталамуса: преоптической областью и дугообразным ядром. Эти клетки вырабатывают гонадотропин-рилизинг-гормоны, которые ускоряют созревание фолликулов в яичниках, овуляцию, «созревание» матки и циклические изменения в эндометрии. У мальчиков они ответственны за рост, маскулинизацию, развитие яичек и сперматогенез.
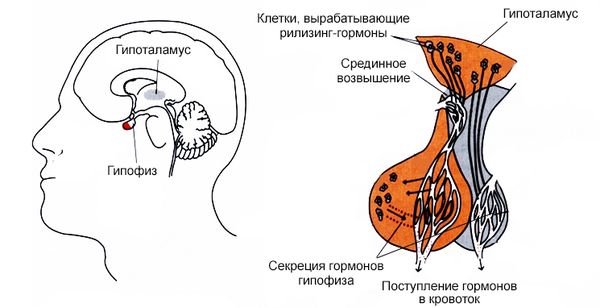
Гипоталамо-гипофизарная система
Кроме того, гипоталамус организует потребление пищи через сложные нейронные связи, контролирующие чувство голода и насыщения. Дугообразное ядро выступает в роли регулятора инсулина, питательных веществ в крови (например, глюкозы, свободных жирных кислот, аминокислот) и циркулирующих в кишечнике пептидов, включая лептин. Все эти вещества достигают мозга через сосуды срединного возвышения, которые переносят выделяемые гипоталамусом вещества в гипофиз.
Лептин происходит из жировых клеток и регулирует аппетит. Ожирение возникает при наследственном дефиците этого гормона или нечувствительности гипоталамуса к нему. При краниофарингиоме может нарушиться срединное возвышение и соседнее дугообразное ядро, что вызывает нечувствительность гипоталамуса к лептину, из-за чего человек постоянно ощущает голод и переедает.
Кроме того, у больных часто повышается уровень инсулина, что делает жировые клетки более чувствительными к глюкозе. В результате производится больше лептина, и гипоталамус теряет чувствительность к нему.
Также краниофарингиомы могут повредить супрахиазматические ядра гипоталамуса и нарушить циркадный ритм, что также приводит к увеличению веса.
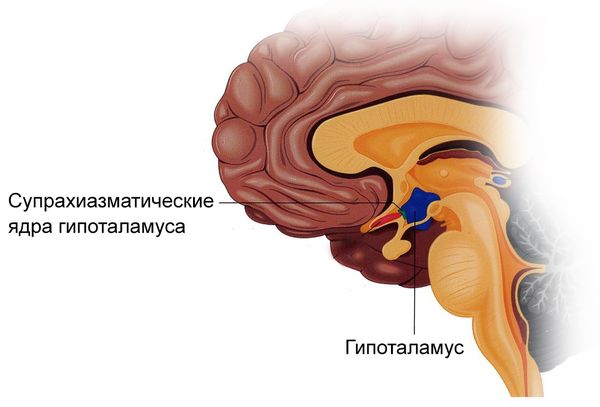
Супрахиазматические ядра гипоталамуса
Ожирение также способствует низкая физическая активность, наблюдаемая у большинства пациентов с адипозогенитальной дистрофией. Это объясняется ослабленным влиянием гипоталамуса на симпатическую нервную систему и отсутствием мотивации. Также из-за нарушения связи между областями гипоталамуса, отвечающими за сон и бодрствование, может возникать патологическая дневная сонливость, что также снижает активность.
При наличии опухоли в гипоталамусе или гипофизе может происходить сдавливание окружающих тканей, в первую очередь зрительных нервов, из-за чего возникают проблемы со зрением.
Краниофарингиомы, затрагивающие гипоталамус, помимо адипозогенитальной дистрофии, могут привести к несахарному диабету из-за недостатка вазопрессина. В результате человек испытывает неутолимую жажду и способен выпить до 20 литров воды в день, что приводит к частым мочеиспусканиям.
При краниофарингиомах в гипофизе поступает недостаточное количество рилизинг-гормонов гипоталамуса. Вследствие этого может развиться пангипопитуитаризм — состояние, при котором уровень гормонов гипофиза снижен: тиреотропный гормон, соматотропный гормон, гонадотропины и дофамин. Это сопровождается симптомами гипотиреоза, гипокортицизма и гипогонадизма.
Классификация и стадии развития адипозогенитальной дистрофии
Нет определенных видов и стадий адипозогенитальной дистрофии. Единственное различие может быть в причинах заболевания и наличии различных осложнений. В Международной классификации болезней (МКБ-10) адипозогенитальная дистрофия относится к категории «Другие болезни гипофиза» (код E23.6).
Компликации адипозогенитальной дистрофии
Если лечение не начать своевременно, то руки и ноги могут быть непропорционально развиты. Кроме того, у пациентов с отставанием могут возникнуть проблемы с половыми железами, что может вызвать нарушение потенции и импотенцию у мужчин, вторичную аменорею и женское бесплодие у женщин.
Длительное понижение уровня половых гормонов может привести к развитию остеопороза (хрупкости костей), что увеличивает вероятность переломов. Также растет риск атеросклероза.
Избыточный вес и повышенный уровень сахара могут способствовать развитию сердечно-сосудистых патологий, включая ишемическую болезнь сердца. Могут возникнуть нарушения толерантности к углеводам (предиабет) и сахарный диабет. При поражении гипоталамуса-гипофизарного тракта может быть нарушена секреция вазопрессина, что приводит к развитию не сахарного диабета.
Среди осложнений также можно выделить дискинезию желчевыводящих путей, что приводит к застою желчи и образованию желчных камней. Это может быть вызвано насыщением желчи холестерином, что приводит к ее кристаллизации.
При большом или растущем опухоли головного мозга может быть сдавлены окружающие ткани, что сопровождается нарушениями зрения (ограничением полей зрения, развитием застойного диска зрительного нерва, высокой степенью близорукости или дальнозоркости, язвой роговицы). Атрофия зрительного нерва может привести к слепоте.
Диагностика адипозогенитальной дистрофии
Чтобы установить диагноз, нужно пройти осмотр у педиатра и эндокринолога, изучить анамнез жизни, перенесенные нейроинфекции и черепно-мозговые травмы. Также доктор может подозревать адипозогенитальную дистрофию при жалобах на приступы булимии.
При осмотре врач обратит внимание на избыток веса или ожирение по женскому типу, евнухоидные пропорции и отсутствие половых признаков у подростков.
Окончательный диагноз определяется на основе лабораторных и инструментальных исследований. При заболевании будет уменьшен уровень половых гормонов (ФСГ, ЛГ, тестостерона и эстрогена). Также необходимо сдать анализ на гормон роста.
При рентгенографии черепа, КТ области турецкого седла или МРТ головного мозга могут быть обнаружены опухоли, кровоизлияния и различные деформации.
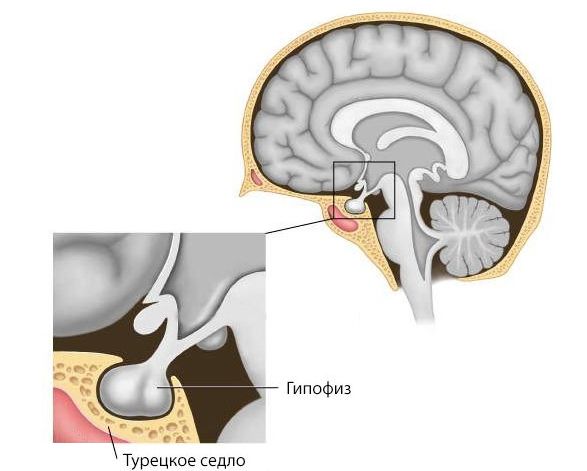
Турецкое седло
Наиболее чувствительным и предпочтительным методом диагностики является МРТ головного мозга.
Также необходимо оценить костный возраст, для этого проводят рентгенографию кисти недоминантной руки с лучезапястным суставом. При адипозогенитальной дистрофии костный возраст отстаёт от паспортного.
Дифференциальная диагностика
Синдром Фрелиха нужно отличать от следующих заболеваний:
- Экзогенно-конституционального ожирения. При такой форме ожирения может быть задержка полового развития и евнухоидные пропорции тела, но характерен высокий рост. Для дифференциальной диагностики оценивают базальный уровень гонадотропных гормонов, ЛГ и ФСГ. В сомнительных случаях проводят пробу с аналогом гонадотропин-рилизинг-гормона.
- Синдрома Иценко — Кушинга. Характерно ожирение и нарушение полового развития, но ещё наблюдается задержка роста, фиолетовые стрии на коже, повышение артериального давления и кортизола в анализах крови.
- Синдромальногое ожирения (синдромы Барде — Бидля, Прадера — Вилли и другие редкие болезни). Синдром Прадера — Вилли — это самая частая синдромальная форма ожирения, при которой ребёнок отстаёт в развитии уже с младенчества, в 1–3 года начинает переедать, присутствуют характерные признаки — длинноголовость, уменьшение размеров кистей и стоп, тонкие губы с опущенными вниз углами, миндалевидные глаза, косоглазие. У новорождённых наблюдаются проявления гипогонадизма — уменьшение размеров наружных половых органов и крипторхизм. С возрастом ребёнок плохо растёт, отстаёт в психомоторном развитии. Для синдрома Барде — Бидля характерно ожирение, пигментный ретинит, наличие дополнительных пальцев на кистях или стопах (полидактилия), умственная отсталость, гипогонадизм, аномалии развития почек и почечная недостаточность. Среди синдромальных форм ожирения в сочетании с гипогонадизмом также встречаются синдром Паллистера, при котором наблюдается дефект локтевой кости, нарушение развития грудных желёз и зубов. Также в редких случаях может встречаться синдром Карпентера, при котором наблюдается «башенная» форма черепа, сращение одного или нескольких пальцев, полидактилия и сниженный интеллект. Синдром Борджесона проявляется ожирением, умственной отсталостью, судорогами и нарушением работы половых органов. Для дифференциальной диагностики с перечисленными синдромами проводят генетическое исследование .
- Моногенных форм ожирения. Такие формы в сочетании с гипогонадизмом встречаются крайне редко, отличаются ранним дебютом (с первых месяцев жизни — до 1 года), аномально сильным чувством голода, приводящим к перееданию. Для большинства пациентов характерно нормальное нервно-психическое развитие. Моногенные формы ожирения развиваются из-за мутации одного из генов, кодирующих белки лептин-меланокортиновой системы. Диагностику этих форм ожирения также проводят с помощью генетического анализа .
Лечение адипозогенитальной дистрофии
Методы терапии адипозогенитальной дистрофии включают проведение операции и назначение лекарственных препаратов. Соблюдение правильного питания и активный образ жизни также неотъемлемая часть лечения.
Для излечения последствий нейроинфекций обычно требуется консультация с неврологом.
Хирургическое вмешательство
Если адипозогенитальная дистрофия возникла из-за опухоли гипоталамуса или гипофиза, то понадобится операция или проведение лучевой терапии. Врачи, такие как невролог, нейрохирург и офтальмолог, определяют стратегию лечения. После удаления опухоли проводят комплексную заместительную терапию кортикостероидами и гормонами щитовидной железы, а также гонадотропинами. После операции часто возникает гипопитуитаризм, в таких случаях необходимо постоянное прием гормональных препаратов.
Питание и образ жизни
Для успешного лечения адипозогенитальной дистрофии важно изменить образ жизни и питание: быть более активным, уменьшить калорийность, сократить потребление легкоусвояемых углеводов и животных жиров. Рекомендуется исключить из рациона сладости, хлебобулочные и мучные изделия, макароны, картофель, сладкие напитки, газировку, жирные продукты. Можно употреблять овощи, телятину, курицу без кожи, нежирные молочные продукты, грибы и бобовые. Важно также быть активным физически — ходить, плавать, кататься на велосипеде или бегать.
Лечение препаратами
Для стабилизации гормонального фона в период полового созревания необходимы гормональные препараты. Они содействуют развитию вторичных половых признаков, росту и восстановлению фертильности. Важно контролировать побочные эффекты заместительной терапии, такие как эритроцитоз. Девочкам с гипогонадизмом на фоне адипозогенитальной дистрофии рекомендуется применять препараты эстрадиола. После достижения стабильности работы половых органов добавляют препараты прогестерона. Препараты булимии помогают сдерживать аппетит и ускорять метаболизм, снижая всасывание жиров.
Прогноз. Профилактика
Если у синдрома есть непонятное происхождение, то лечение чаще всего более эффективно и прогноз благоприятнее, чем при серьезных системных эндокринных, наследственных, онкологических или других заболеваниях.
Если синдром вызван краниофарингиомой и произведена операция, то опухоль впоследствии может вернуться, так как её нельзя полностью удалить. Также после операции может развиться пангипопитуитаризм, при котором уровень многих гормонов гипофиза снижается.
Подросткам с избыточным весом рекомендуется регулярное наблюдение, оценка индекса массы тела и питания.
При лечении гипогонадизма рекомендуется посещать детского эндокринолога раз в полгода. На консультации врач оценивает рост, пропорции тела и стадию полового развития по Таннеру.
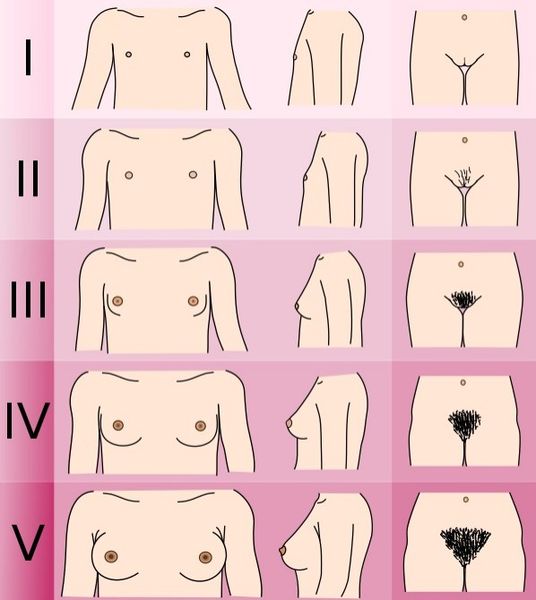
Стадии полового развития по Таннеру
Девочек с гипогонадизмом необходимо наблюдать вместе с детским гинекологом.
Детям и подросткам с психологическими проблемами из-за задержки полового развития, неправильных пропорций тела и последствий заместительной терапии понадобятся консультации психолога и психологическая реабилитация.
Профилактика возможна только для адипозогенитальной дистрофии, вызванной инфекциями (например, вакцинация поможет предотвратить заражение).
Список литературы
- Михаил Александрович Жуковский. Педиатрическая эндокринология. — Издательство «Медицина», 1971 год. — Страница 315.
- Работа Российской ассоциации эндокринологов «Гипогонадизм у детей и подростков: проект клинических рекомендаций». — Издательство, 2021 год. — 56 страниц.
- Проект Российской ассоциации эндокринологов «Ожирение у детей: клинические рекомендации». — Издательство, 2021 год. — 77 страниц.
- Федеральные клинические рекомендации (протоколы) Российской ассоциации эндокринологов по ведению детей с эндокринными заболеваниями / под ред. Игоря Игоревича Дедова, Валентины Александровны Петерковой. — Издательство «Практика», 2014 год. — 442 страницы.
- Ирина Михайловна Русинко, Наталья Михайловна Русинко, Ольга Григорьевна Коноплева и др. Адипозогенитальная дистрофия как причина гинекомастии у подростков и молодых мужчин: этические и медицинские аспекты. Лечебная стратегия уролога // Журнал «Здоровье мужчины». — 2014. — Выпуск 2. — Страница 155.
- Ирина Михайловна Русинко, Наталья Михайловна Русинко, Ольга Григорьевна Коноплева. Особенности терапии адипозогенитальной дистрофии и гипогонадотропного гипогонадизма у подростков // Журнал «Здоровье мужчины». — 2014. — Выпуск 2. — Страница 167.
- Erfurth E.-M. Диагностика, причины и лечение повреждения гипоталамуса при краниофарингиоме // Нейроэндокринология. — 2020. — Выпуск 9–10. — Страницы 767–779.ссылка
- Gordon C. M., Ackerman K. E., Berga S. L. и др. Функциональная аменорея по гипоталамическому типу: клинические рекомендации от Американского эндокринологического общества // Журнал «J Clin Endocrinol Metab». — 2017. — Выпуск 5. — Страницы 1413–1439. ссылка
- Хельмут Людвиг Мюллер. Лечение гипоталамического ожирения // Клинические препараты по эндокринологии и метаболизму. — 2020. — Выпуск 3. — Страницы 533–552.ссылка
- Игорь Хохберг, Захария Хохберг. Гипоталамическое ожирение // Развитие эндокринной системы. — 2010. — Том 17. — Страницы 185–196. ссылка
- Светлана Самарасингхе, Марко Андреа Эмануэле, Антонио Маджхари. Нейрология гипофиза // Руководство по клинической неврологии. — 2014. — Том 120. — Страницы 685–701. ссылка
- Синдром Фрелиха // Национальная организация по редким заболеваниям. — 2019 год.
- Исабель Кастро-Дуфурни, Рикардо Карраско, Рикардо Прието, Хосе Мария Паскуал. Синдром инфундибуло-туберального поражения: начала клинической нейроэндокринологии во Франции // Журнал «Гипофиз». — 2015. — Выпуск 6. — Страницы 838–843. ссылка
- Хосе Мария Паскуал, Рикардо Прието, Марио Росдольски. Краниофарингиомы, преимущественно поражающие гипоталамус // Справочник по клинической неврологии. — 2021. — Том 181. — Страницы 75–115. ссылка
- Луиджи Бонфрате, Джейсон Ванг, Грегорио Гаррути, Пьетро Портинкаса. Ожирение и риск развития желчнокаменной болезни и панкреатита // Лучшие практики по клинической гастроэнтерологии. — 2014. — Выпуск 4. — Страницы 623—635.ссылка
- Союз педиатров России. Клинические рекомендации по желчнокаменной болезни. — Издательство, 2021 год. — 35 страниц.
- Международная статистическая классификация болезней и смежных проблем 10-го пересмотра (МКБ-10). Глава IV Эндокринные, питательные и метаболические заболевания (E00-E90). — 2019 год.
- Адипозогенитальная дистрофия. В книге «Большая Медицинская Энциклопедия» / под ред. Бориса Васильевича Петровского. — 3-е издание [Электронный ресурс]. Дата обращения: 19.02.2021.
- Ирина Владимировна Копылова, Станислав Петрович Блох, Маргарита Анатольевна Карева и др. Эстрогенизация наружных половых органов у девочек с врожденной дисфункцией коры надпочечников в период пубертата // Журнал «Проблемы репродукции». — 2014. — Выпуск 2. — Страницы 35–42.
Симптомы и клиническая картина
Адипозогенитальная дистрофия характеризуется различными клиническими проявлениями, включая поражения головного мозга и гипофиза. Симптомы могут быть разнообразными и включать в себя такие проявления, как аденомы гипофиза, водянка желудочков мозга, менингит третьего желудочка, различные нейроинфекции и энцефалит.
В раннем детстве адипозогенитальная дистрофия может проявляться через наследственные факторы или в результате перенесенных инфекций, таких как туберкулез или вирусные заболевания головного мозга. Важно отметить, что данное заболевание не передается по наследству, но может быть обусловлено различными факторами, включая воздействие внешних воздействий и возможных мутаций.
Методы лечения и реабилитации
В данном разделе планируется рассмотреть методы лечения и реабилитации пациентов, страдающих адипозогенитальной дистрофией, вызванной различными причинами, включая наследственные факторы, инфекции, опухоли и другие заболевания. Такие причины, как туберкулёз, сифилис, энцефалит, менингит, а также опухоли головного мозга, включая аденомы гипофиза, могут вызывать развитие данного заболевания.
Лечение адипозогенитальной дистрофии включает в себя комплексный подход, направленный на устранение основной причины заболевания. В случае инфекционного характера заболевания проводится антибактериальная или антивирусная терапия, в зависимости от возбудителя. При наличии опухолевого процесса может потребоваться хирургическое вмешательство.
После проведения основного лечения необходимо начинать процесс реабилитации пациента. Это включает в себя комплекс мероприятий, направленных на восстановление функций организма, улучшение общего состояния пациента, а также предупреждение возможных осложнений и повторных случаев заболевания. Физиотерапия, лечебный массаж, специальные диеты и упражнения помогают пациентам быстрее вернуться к обычной жизни.
Современные исследования и перспективы лечения
Некоторые случаи адипозогенитальной дистрофии могут быть связаны с перенесённым туберкулёзом, менингитом или даже сифилисом. Раннее обнаружение и лечение таких нейроинфекций могут помочь предотвратить развитие данного заболевания в будущем.
Одним из направлений исследований является поиск эффективных методик лечения адипозогенитальной дистрофии, в том числе разработка новых препаратов и методов рехабилитации. Также активно изучаются возможности хирургического вмешательства при наличии критической степени заболевания, например, при развитии водянки желудочков мозга.
Видео по теме:
Вопрос-ответ:
Как проявляется адипозогенитальная дистрофия?
Адипозогенитальная дистрофия проявляется прогрессирующим ожирением и снижением работы половых желез. Это заболевание обычно проявляется в возрасте 6-13 лет и чаще встречается у мальчиков.
Чем вызвано появление адипозогенитальной дистрофии?
Адипозогенитальная дистрофия может возникать при наличии краниофарингиомы, водянки третьего желудочка головного мозга, нейроинфекций (например, энцефалит, менингит) или из-за аденомы гипофиза. Это редкое заболевание обусловлено поражением гипофиза и гипоталамуса.
Какое лечение предполагается при адипозогенитальной дистрофии?
Лечение адипозогенитальной дистрофии нацелено на коррекцию эндокринных нарушений и устранение симптомов. Обычно применяются гормоны, назначается специальная диета и физические упражнения. В некоторых случаях может потребоваться хирургическое вмешательство.
Может ли адипозогенитальная дистрофия быть наследственной?
Адипозогенитальная дистрофия не передается по наследству. Это заболевание обычно возникает в результате различных патологических процессов в гипофизе и гипоталамусе, таких как опухоли, инфекции или другие поражения.
Какие другие названия используются для адипозогенитальной дистрофии?
Адипозогенитальная дистрофия также известна как синдром Фрелиха или синдром Пехкранца-Бабинского-Фрелиха. Эти названия происходят от фамилий ученых, которые впервые описали это редкое заболевание нейроэндокринной системы.
Как проявляется адипозогенитальная дистрофия?
Адипозогенитальная дистрофия проявляется прогрессирующим ожирением и снижением функции половых желёз. Обычно заболевание начинается в возрасте 6–13 лет у мальчиков.